Produktbeschreibung
LAVANID® 1/2 sind sterile und iso-osmotische Wundspüllösungen auf Basis der Ringer-Lösung mit 0,02 % (LAVANID® 1) bzw. 0,04 % (LAVANID® 2) Polyhexanid zur Konservierung. Polyhexanid (PHMB) verhindert das Wachstum von Mikroorganismen in Wundauflagen und in der Lösung. Weiterhin wird die Oberflächenspannung der Lösung herabgesetzt, damit diese besser und effektiver an das Gewebe gelangen kann. Dieser tensidähnliche Effekt unterstützt die effektive Reinigung der Wunde.
LAVANID® 1/2 - Wundspüllösungen sind zudem isoton. Durch die Anwendung einer isotonen Lösung wird das Quellen der Haut und die Reizung des Wundbereichs verhindert, da kein Flüssigkeits- bzw. Elektrolytaustausch mit den körpereigenen Sekreten stattfindet. Darauf beruht auch nicht zuletzt die in der Literatur¹ beschriebene gute Eignung zur Wundversorgung und die sehr gute Verträglichkeit von LAVANID® 1/2.
Einsatzmöglichkeiten
LAVANID® 1/2 - Wundspüllösungen eignen sich:
- zur lokalen Wundspülung und Wundreinigung bei chronischen und akuten Wunden
- für den intraoperativen Einsatz
- für empfindliche Wunden, z.B. Verbrennungen 2. Grades
- für NPWT (Unterdrucktherapie)
- zur Befeuchtung von Tüchern, Tamponaden und Verbänden
Anwendung
Eine Wunde sollte bei jedem Verbandswechsel zuerst von Schmutz, Blut und Belägen mit Wundspüllösung gereinigt werden. Hierzu werden die betroffenen Areale unterstützend mit LAVANID® 1/2 - Wundspüllösung gespült. Die Lösung kann durch Aufschrauben der Flasche und Ausgießen der Lösung appliziert werden. Alternativ ist eine aseptische Entnahme über den Stopfenverschluss mittels Spike möglich. Eine Spike ist im Lieferumfang nicht enthalten.
LAVANID® 1/2 - Wundspüllösungen sind farblos und ermöglichen dadurch eine uneingeschränkte Beurteilung des Wundzustandes, wodurch sich die Wundversorgung einfacher gestalten lässt. Die schmerzfreie Anwendung sorgt für eine hohe Patientenakzeptanz.
Zusammensetzung
Ringerlösung (isotone Elektrolytlösung bestehend aus Natriumchlorid, Kaliumchlorid, Calciumchlorid 2 H₂O, Wasser für Injektionszwecke), Macrogol, Polyhexanid 0,02 % (LAVANID® 1) bzw. Polyhexanid 0,04 % (LAVANID® 2).
Haltbarkeit:
Die Aufbrauchfrist nach dem ersten Öffnen beträgt 2 Monate.
Umweltinformation
Die Entwicklung und Herstellung erfolgt bei SERAG-WIESSNER GmbH & Co. KG immer unter höchsten Umweltstandards, gemäß ISO 14001:2015.
Downloads
- Anwendungsbeispiele zur modernen Wundversorgung Stand 01/2023 - Art.Nr. 851190
- Bausteine für die systematische Wundbehandlung Stand 08/2023 - Art.Nr. 851122
Gebrauchsanweisungen
Zu erwartende Risiken in Verbindung mit der bestimmungsgemäßen Verwendung des Produktes sind in der Gebrauchsanweisung angegeben.
Weiterführende Informationen
Anwendung LAVANID® 1/2 - Wundspüllösung mittels Spikes

Anwendung LAVANID® 1/2
Ausgießen der Lösung mit Schraubverschluss.
*Der abgebildete Spike ist im Lieferumfang nicht enthalten.

Anwendung mittels Spike*
Entfernen der Aluminiumfolie und Desinfektion der Einstichfläche.
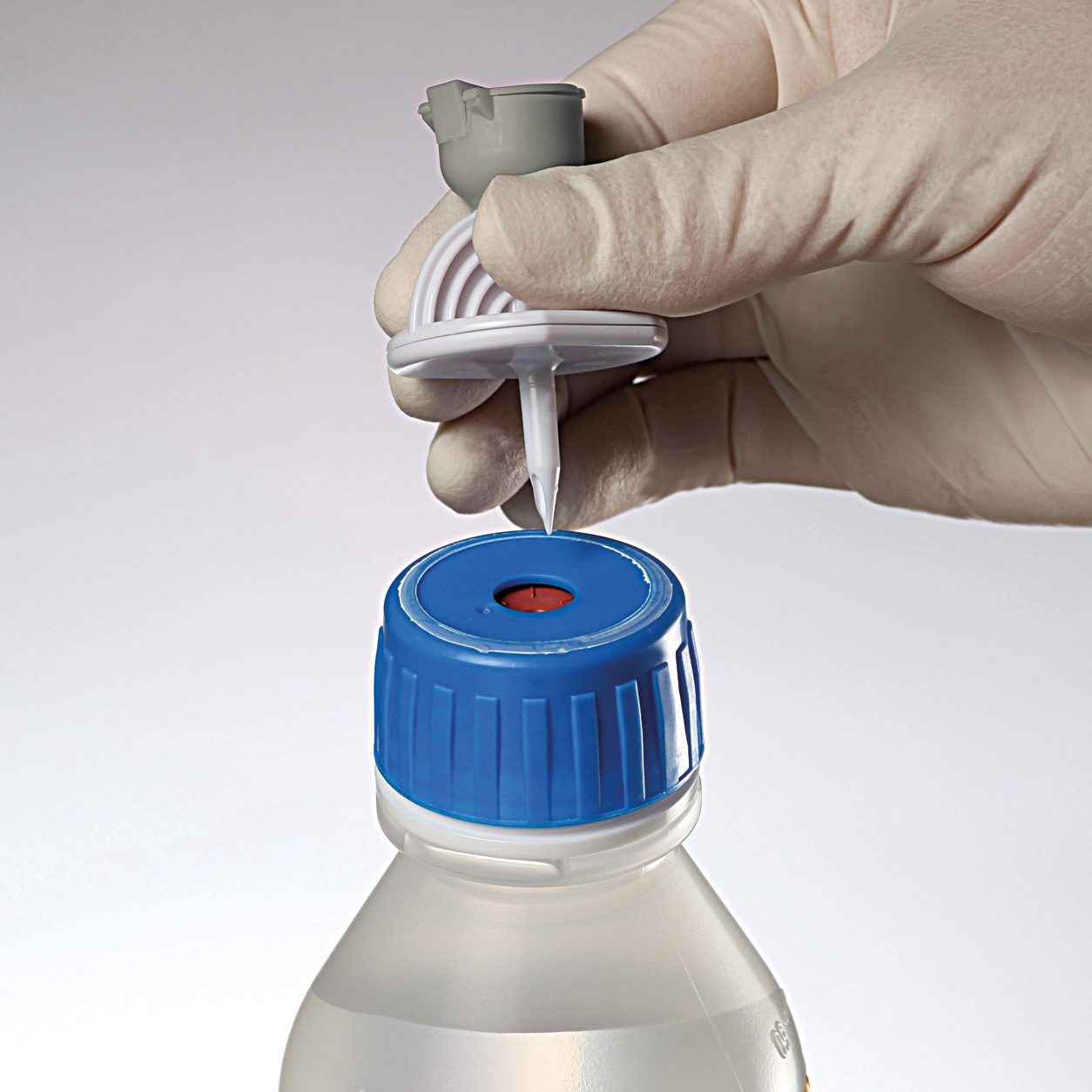
Anwendung mittels Spike*
Aufsetzen des Spikes*.
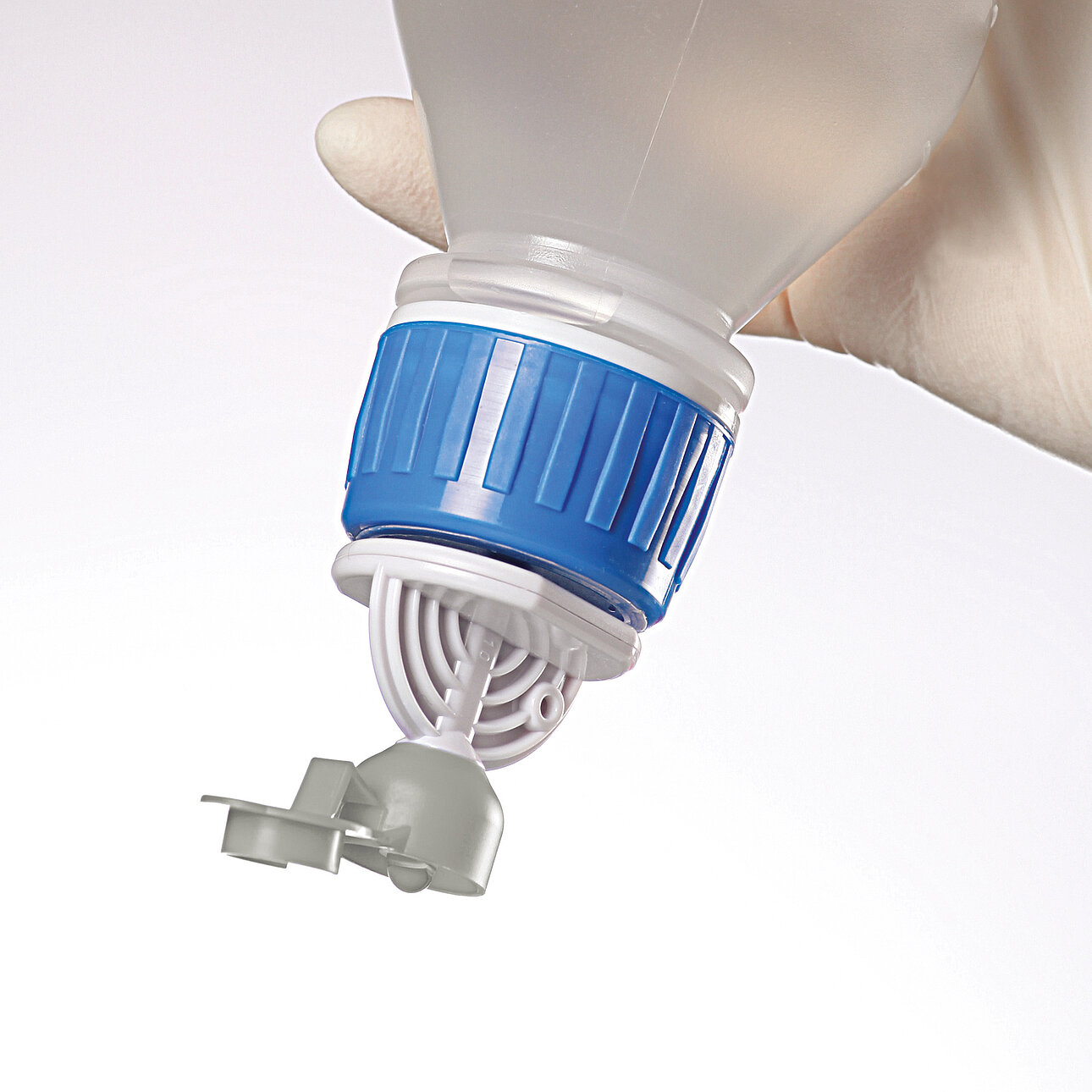
Anwendung mittels Spike*
Flasche mit aufgesetzten Spike* zur aseptischen Entnahme.
Lieferprogramm
| Art.-Nr. | PZN | Behältnis/Inhalt | VPE | |
|---|---|---|---|---|
| 014124 | 05901297 | Plastikflasche PP SV 125ml | 20 | |
| 014125 | 02178452 | Plastikflasche PP SV 250ml | 10 | |
| 014127 | 02178498 | Plastikflasche PP SV 1000ml | 6 | |
| E14124 | 05901305 | Plastikflasche PP SV 125ml | 1 | |
| E14125 | 02178423 | Plastikflasche PP SV 250ml | 1 | |
| E14127 | 02178475 | Plastikflasche PP SV 1000ml | 1 |
| Art.-Nr. | PZN | Behältnis/Inhalt | VPE | |
|---|---|---|---|---|
| 014224 | 05901274 | Plastikflasche PP SV 125ml | 20 | |
| 014225 | 02178564 | Plastikflasche PP SV 250ml | 10 | |
| 014227 | 02178587 | Plastikflasche PP SV 1000ml | 6 | |
| E14224 | 05901280 | Plastikflasche PP SV 125ml | 1 | |
| E14225 | 02178529 | Plastikflasche PP SV 250ml | 1 | |
| E14227 | 02178570 | Plastikflasche PP SV 1000ml | 1 |
Literaturhinweise
1 Kramer et al., ZfW 2004; 3: 110-120, bestätigt durch Dissemond et al., ZfW, 2009; 1: 20-26; zuletzt bestätigt durch Kramer et al., Skin Pharmacol Physiol; 2018;31:28–58
2 Kallenberger et al., Hyg. Med.; 1991;16: 383-395.

